|
| ИНФОРМАЦИЯ
| |||||||||||||||||||
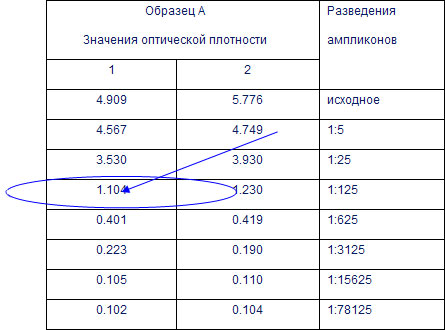
Оптимизация метода выделения провирусной ДНК вируса иммунодефицита человека 1 из цельной кровиСборник тезисов 5-й Всероссийской Башкирова Л. Ю., Богословская Е. В., Шипулин Г. А. Центральный научно-исследовательский институт эпидемиологии МЗ РФ, г. Москва. ВведениеДля диагностики ВИЧ-инфекции используется иммуноферментный анализ (обнаружение в крови антител к ВИЧ) с последующим подтверждением положительных результатов анализа методом иммуноблоттинга. Однако, метод ИФА не эффективен для диагностики Для ПЦР-диагностики ВИЧ-инфекции в России используется две Одним из недостатков этих тест-систем является нестандартизованный метод выделения ДНК из клеток крови, требующий определенных навыков работы. При недостаточном уровне подготовки персонала данный метод может привести к значительному снижению чувствительности анализа и большому количеству ложноотрицательных результатов. В связи с этим целью настоящей работы была разработка и апробация полуавтоматического метода выделения провирусной ДНК вируса иммунодефицита человека из цельной крови. Материалы и методыВ работе исследовали цельную кровь, полученную от 205 Анализ крови на наличие ДНК ВИЧ осуществляли с помощью ПЦР Получение лейкоцитов из цельной кровиЛейкоциты крови получали двумя способами: 1. С помощью методики, используемой 2. С помощью разработанной нами полуавтоматической методики. Методика выделение лейкоцитов из цельной крови, используемая Методика заключается в селективном лизисе эритроцитов крови с помощью раствора «Гемолитик». Для анализа использовали 250 мкл цельной крови. В результате Полуавтоматическая методика выделения лейкоцитов из цельной крови. В основу разработанной нами методики был положен принцип иммуной сорбции клеток крови, содержащих CD4 рецепторы (т. е. тех клеток, которые инфицирует и в геном которых интегрирует вирус иммунодефицита человека). В качестве «сорбента» использовали парамагнитные частицы, покрытые моноклональными антителами, специфичные Для выделения клеток использовали 1 мл цельной крови, в которую добавляли 30 мкл магнитных частиц. После инкубации и отмывки иммунокомплекса, состоящего из магнитных частиц и СD4 лимфоцитов, получали чистую фракцию Лизис клетокКлетки крови, полученные двумя способами, лизировали с помощью раствора «Цитолизин» при температуре 600°С 30 минут. Амплификация. Выделенную с помощью выше описанных методик ДНК переносили в реакционную смесь для проведения реакции амплификации. Реакционная смесь для ПЦР содержала биотинилированные праймеры, комплементарные области pol ВИЧ1. Амплификацию проводили по программе: 950°С — 5 минут, 5 циклов: 950°С — 15 секунд, 550°С — 15 секунд, 720°С — 15 секунд, 30 циклов: 950°С — 15 секунд, 580°С — 15 секунд, 720°С — 15 секунд. Детекция продуктов амплификации. Детекцию осуществляли методом Анализ результатовПробу считали положительной, если оптическая плотность в лунках микропланшета превышала 0,35 ОЕ. Пробу считали отрицательной, если оптическая плотность в лунках микропланшета была меньше 0,35 ОЕ. Для сравнения двух методик выделения ДНК на этапе ГИФА анализировали не только исходные образцы ампликонов, но и их разведения (для получения результатов оптической плотности в пределах линейного диапазона спектрофотометра от 0,35 до 2,0 ОЕ). Для этого перед началом проведения ГИФА из исходного ампликона делали серию последовательных РезультатыСравнение разных методик выделения ДНК показало, что в обоих случаях были получены положительные результаты, как в исходных продуктах амплификации, так и в их разведениях, причем количество разведений с положительным результатом было одинаковым (табл. 1.). Как видно из таблицы 1 значения оптических плотностей в максимальных разведениях (1:625) не отличались друг от друга. Таблица 1. Результаты ГИФА детекции продуктов амплификации, взятых в разведениях.
1 — результаты, полученные при использовании методики выделения ДНК с использованием раствора «Гемолитик». 2 — результаты, полученные при использовании полуавтоматической методики выделения ДНК. В процессе апробации разработанной методики на клиническом материале в сравнении с методикой, используемой ЗаключениеЭффективность выделения ДНК с помощью разработанной полуавтоматической методики была идентична эффективности методики, используемой | ПубликацииНовости
|
| © 2007-2025, Федеральный | ||
Купить планетарный редуктор с доставкой по городу. | ||